 Certains papillomavirus humains peuvent entrainer, à l'occasion de rapports sexuels, une
contamination génitale qui peut parfois diffuser sur le
col de l'utérus. Cette infection guérit spontanément dans la majorité des cas mais
peut aussi aboutir à une infection chronique qui colonise certaines
cellules du col utérin, risquant à long terme de dégénérer en cancer du
col. Afin de prévenir ces infections génitales, une vaccination ciblée
sur ces virus spécifiques est proposée aux jeunes
filles pré-adolescentes avant le début de leur vie sexuelle. Des
polémiques existent cependant depuis le début de leur utilisation
portant à la fois sur une efficacité hypothétique et aussi sur la
possibilité de survenue d'effets indésirables graves.
Certains papillomavirus humains peuvent entrainer, à l'occasion de rapports sexuels, une
contamination génitale qui peut parfois diffuser sur le
col de l'utérus. Cette infection guérit spontanément dans la majorité des cas mais
peut aussi aboutir à une infection chronique qui colonise certaines
cellules du col utérin, risquant à long terme de dégénérer en cancer du
col. Afin de prévenir ces infections génitales, une vaccination ciblée
sur ces virus spécifiques est proposée aux jeunes
filles pré-adolescentes avant le début de leur vie sexuelle. Des
polémiques existent cependant depuis le début de leur utilisation
portant à la fois sur une efficacité hypothétique et aussi sur la
possibilité de survenue d'effets indésirables graves.
Vous avez dit papillomavirus ?
Les papillomavirus appartiennent à une
famille de virus qui compte plus d'une centaine de variants ou génotypes. On
nomme en anglais "human papillomavirus" (HPV) les génotypes
spécifiques à l'espèce humaine qui sont environ 80. Ils sont différenciés par
un numéro qui correspond à leur ordre chronologique de découverte. Ce sont des
virus à ADN, "nus" (sans enveloppe). Ces virus sont pourtant très
résistants aux conditions environnementales (froid, chaleur, solvants, agents
chlorés, antiseptiques…) et conservent donc leur contagiosité dans le milieu
extérieur.
1. Certains types de HPV se propagent surtout
par contacts cutanés et sont à l'origine des verrues vulgaires (HPV 1, 2, 4,
27, 29, 57, 75) ou des verrues planes sur le visage le plus souvent (HPV 3, 10, 28).
Ces verrues sont d'évolution bénigne, même si elles sont parfois d'évolution
prolongée ou récidivante.
2. D'autres
sous-types viraux (HPV 6, 11, 54) ont une localisation génitale et occasionnent
des verrues appelées condylomes, pouvant se localiser sur la vulve, le périnée,
le pénis, l'anus. Ces verrues peuvent avoir un aspect bourgeonnant (condylomes
acuminés ou "crêtes de coq"), ou un peu bombé (condylomes papuleux).
 |
| Condylomes acuminés |
On
n'observe quasiment pas ce type de verrues chez l'enfant car ils se
transmettent par voie sexuelle plus que cutanée. Ils touchent indifféremment
les hommes et les femmes jeunes, principalement au début de leur vie sexuelle.
Le risque de contamination est très important même après un seul rapport sexuel
avec une personne porteuse, mais l'apparition des condylomes ne se fait
qu'après 3 à 6 mois suivant la contamination. Quelquefois le virus peut rester
latent plusieurs mois ou années. Ce portage asymptomatique, sans lésion visible
est très fréquent, concernant presque un quart de la population de moins de 25
ans sexuellement active. La virulence, ou au contraire la mise au repos du
virus, reste inexpliquée.
Ces papillomavirus étant résistants aux conditions
environnementales, une transmission indirecte par l'eau, du linge de
toilette ou du matériel souillé est possible, de même que par les saunas ou les
jacuzzis. L'utilisation du préservatif s'avère moyennement efficace envers la
contamination par ces virus HPV. La régression spontanée est possible, mais
l'évolution classique est habituellement l'extension des lésions en taille et
en nombre, occasionnant donc une gêne esthétique. Il n'y a jamais d'évolution
cancéreuse, mais les récidives sont très fréquentes.
3. La
troisième famille des HPV est représentée par des génotypes responsables de
contaminations muqueuses (anus, bouche, pharynx, œsophage) et génitales (pénis,
vulve, vagin, col de l'utérus). Cette infection est très fréquente puisque l'on
considère que plus de 70% des personnes ayant une activité sexuelle rencontrent
ce type de HPV au moins une fois dans leur vie. La contamination se fait
également à l'occasion de rapports sexuels ou même par simple contact cutané.
Une quinzaine de souches possèdent un potentiel cancérigène élevé (HPV 16 et 18
surtout, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82...) du fait de leur
capacité à s'intégrer au génome des cellules infectées [1].
Les types les plus courants de HPV à haut risque varient selon les pays. Chez
la femme, une contamination génitale peut occasionner une diffusion de virus
sur le col de l'utérus qui guérit dans la majorité des cas puisque le virus
disparait spontanément en 12 mois à 24 mois (90%).
Ce n'est donc simplement que chez 10% des femmes infectées que le virus pourra
persister plusieurs années au niveau du revêtement superficiel du col de
l'utérus, puis colonisant certaines cellules de cette muqueuse, risque ensuite
d'évoluer vers un cancer. Les génotypes les plus souvent responsables (70%)
de ces cancers du col sont les HPV 16 et 18. Ce cancer est attribuable, dans
près de 100 % des cas, à une infection par un ou plusieurs de ces génotypes
d'HPV (dont on peut retrouver l'ADN dans les cellules tumorales).
Ces HPV (surtout le type 16) peuvent être impliqués plus exceptionnellement
dans le développement de cancers ano-génitaux (anus, vulve, vagin, pénis) ou
des voies aérodigestives (bouche, oropharynx) lors de contacts oro-sexuels
aussi bien chez la femme que chez l'homme.
Quand
l'infection à HPV devient
précancéreuse ou cancéreuse :
Lorsqu'un HPV de la 3ème famille s'installe durablement au niveau du col, il peut
s'introduire dans certaines cellules superficielles et y provoquer des
modifications oncogènes, on parle alors de dysplasies. Ces lésions les plus
fréquentes affectent la plupart du temps l’exocol, c'est à dire la partie
externe du col. Un cancer du col de l'utérus peut alors parfois se développer
ensuite sur la première couche muqueuse du col de l'utérus, autrement dit en
surface, sur le tissus qui le recouvre (l’épithélium).
Ces lésions dysplasiques sont aussi qualifiées de "néoplasies
cervicales intraépithéliales" ou CIN. Celles-ci peuvent exister sous
des formes plus ou moins intenses et profonds. Elles sont ainsi classées en
trois grades de gravité (de 1 à 3)selon l'extension en profondeur et le degré
d'invasion de l’épithélium par les cellules anormales (CIN 1, CIN 2 et CIN 3).
 |
| Évolution naturelle des lésions CIN (Ostor, 1993) |
Ces
lésions possiblement "précancéreuses" disparaissent le plus souvent
spontanément, ou peuvent progresser vers une lésion plus sévère ou plus rarement vers
un cancer. Cette évolution est fonction du degré d'invasion du revêtement de la
muqueuse du col. Les lésions classées CIN 1 ne donnent lieu à un cancer que
dans 1% des cas, les CIN 2 dans 1,5% et les CIN 3 dans 12 % des cas. Un cancer
du col survient donc dans 14,5% des 10% de dysplasies persistantes du col utérin, soit donc
dans environ 1,5% de la totalité des infections à HPV initiales. Le type de cancer qui se
développe est alors le plus souvent un "carcinome épidermoïde".
Cette évolution est très lente puisqu'un cancer apparaît généralement 10 à
15 ans après l'infection initiale par le HPV. Il peut mettre 5 à 10 ans
seulement chez des femmes présentant un système immunitaire affaibli (SIDA).
 |
| Colposcopie |
Le dépistage systématique régulier de dysplasies
(CIN) permet une détection précoce de lésions précancéreuses du col
utérin. Ce dépistage existe en France depuis les années 90 et il est désormais
proposé de façon systématique et pris en charge à 100% depuis 2019. Cet examen
simple et indolore repose sur la réalisation préalable d'une colposcopie
(examen à la loupe de l'aspect du col de l'utérus). Un frottis du col utérin
(prélèvement par un écouvillon de cellules situées à la surface du col) est
réalisé puis analysé au microscope. Ce dépistage est recommandé tous les trois
ans chez toutes les femmes âgées de 25 à 65 ans, ayant ou n'ayant pas eu des
relations sexuelles. Dans certains pays, l’utilisation d’un test de recherche
locale de virus HPV précède un frottis complémentaire si le test viral est
positif. La fiabilité de cette méthode très simple serait nettement plus
élevée, évitant les faux négatifs de certains frottis.
En
cas de lésions de haut grade (CIN 3) retrouvées au frottis, une recherche de
l'ADN des virus HPV "à haut risque de cancer" (16, 18...) est
effectuée. On propose alors une "conisation" ("rabotage"
d'une collerette du col utérin) ou un traitement local au laser, traitements
préventifs qui évitent le risque de passage au stade du cancer.
Le
nombre de nouveaux cas recensés de cancers du col en France était de 2920 pour l'année
2018, soit une incidence annuelle de 6 cas pour 100.000 femmes. Le nombre de
décès par cancer a été de 1117 la même année. Le cancer du col de l’utérus
représente 0,7% de l’ensemble des cancers en France et se situe par sa
fréquence au 12e rang des cancers féminins (Réseau FRANCIM). Il peut survenir à
tout âge, cependant l’âge médian de sa découverte est de 51 ans. Une étude de
génotypage des HPV retrouvés chez 516 femmes françaises atteintes d'un cancer
du col a retrouvé le plus souvent le type 16 (73%), puis le HPV 18 (19%) et le
HPV 31 (7%) mais une infection multiple est également possible (22%). [2]
Le tabac
(risque deux fois supérieur par rapport aux non-fumeuses) [3], l’exposition in
utero au diéthylstilbestrol (Distilbène), la survenue d'autres MST
(herpès, chlamydia), l’infection par le VIH (immunodépression), les
contraceptifs oraux prolongés, les rapports sexuels à un âge précoce et les
partenaires sexuels multiples sont associés à une plus grande fréquence de
cancers du col de l’utérus. Des conditions d'hygiène défectueuses ne sont pas
des facteurs de risque prouvé ni le type d'alimentation. Les populations à
faible niveau de vie sont cependant notablement plus à risque, probablement du
fait de l'accessibilité limitée aux soins médicaux préventifs et curatifs.
 |
| Incidence et mortalité annuelles des cancers du col en France |
En
France, l'incidence annuelle du cancer du col est en baisse constante depuis
les années 1980. Elle est passée de 22,4 en 1975 à 6,7/100.000 femmes en 2018
(soit moins 2,5 % par an). Ceci grâce au dépistage systématique par frottis et
la recherche de la présence locale de HPV. Cependant, presque une femme sur
deux (entre 45 et 55 % selon la région) ne fait pas pratiquer de frottis
tous les trois ans, rendant cette prévention moins efficace. Le cancer du col
de l’utérus est un cancer de pronostic moyen avec une survie nette à 10 ans de
59 %. Le taux de mortalité a fortement diminué depuis les années 1980 (moins
3,2% par an) avec cependant un ralentissement de cette baisse depuis les années
2000. Ce taux en 2017 est de 1,7/100.000 [4].
 |
| Incidence du K du col en Europe |
L'incidence
du cancer du col de l'utérus est très variable selon les différentes politiques
de dépistage. Dans les pays développés, des programmes sont le plus souvent en
place pour permettre aux femmes d’être dépistées régulièrement par la technique
du frottis, ce qui permet de déceler la plupart des lésions précancéreuses à
des stades où elles peuvent être facilement traitées. Le traitement précoce
permettrait de prévenir jusqu’à 80% des cancers du col dans ces pays. Par
exemple, l’incidence annuelle est faible, 4,7/100.000, en Finlande où le
dépistage national est organisé depuis 1962, contre 16,6/100.000 en Slovaquie
où aucun programme n'existe. *
Le
chiffre actuel de l'incidence en France de 6,7/100.000 femmes se situe donc
entre ces deux extrêmes, au 7ème rang des pays de l'Union européenne, derrière
Suisse, Finlande, Espagne, Autriche, Luxembourg, Pays-Bas.
 Les pays
en voie de développement regroupent 83 % des nouveaux cas de cancer car
l’accès limité à un dépistage efficace signifie que la maladie n’est souvent
identifiée qu'à un stade avancé. En Afrique subsaharienne, l'incidence annuelle
est de 35/100.000.
Cette fréquence culmine dans les pays d'Afrique du Sud ou l'incidence annuelle
peut dépasser 60/100.000. En outre, les perspectives de traitement de cette
maladie à un stade très avancé sont assez médiocres, d’où un taux de décès plus
important dans ces régions où le cancer du col est la principale cause de
mortalité féminine.
Les pays
en voie de développement regroupent 83 % des nouveaux cas de cancer car
l’accès limité à un dépistage efficace signifie que la maladie n’est souvent
identifiée qu'à un stade avancé. En Afrique subsaharienne, l'incidence annuelle
est de 35/100.000.
Cette fréquence culmine dans les pays d'Afrique du Sud ou l'incidence annuelle
peut dépasser 60/100.000. En outre, les perspectives de traitement de cette
maladie à un stade très avancé sont assez médiocres, d’où un taux de décès plus
important dans ces régions où le cancer du col est la principale cause de
mortalité féminine.
Quels sont les vaccins anti-HPV actuels ?
1. Un
vaccin recombinant dirigé contre 4 génotypes viraux [6, 11, 16 et 18 ] a obtenu
une autorisation de commercialisation en septembre 2006 sous le nom de GARDASIL
(Développé par Merck et commercialisé par Sanofi Pasteur en France). Il a été
remplacé en 2018 par un vaccin équivalent, le GARDASIL 9 mais qui contient 5
génotypes supplémentaires [types 6, 11, 16, 18, 31, 33, 45, 52, 58].
 Ces deux
vaccins recombinants sont préparés par "génie génétique" à partir de
cellules de levures (saccharomyces cerevisiae). Celles-ci servent
"d'usines" où ont été insérés les gènes du HPV, programmés pour
fabriquer la protéine d'enveloppe (appelée L1) de la capside virale (structure
qui entoure l'ADN viral). Ces protéines L1 sont recueillies et purifiées. Elle
peuvent ensuite s'assembler entre elles, 5 par 5, en formant des capsomères L1.
Ceux-ci s'assemblent ensuite entre eux, créant une capside vide que l'on nomme
"pseudo-particule virale" ou VLP puisqu'elle ne contient pas
l'ADN viral, et ne peut donc pas infecter les cellules ni se multiplier. Le
vaccin GARDASIL actuel contient donc 9 types de VLP. La monographie du vaccin
spécifie que ces VLP « ne contiennent pas d'ADN viral, elles ne
peuvent pas infecter les cellules, se multiplier, ni provoquer de
maladies ». Cette affirmation du laboratoire producteur sera remise en
question un peu plus loin.
Ces deux
vaccins recombinants sont préparés par "génie génétique" à partir de
cellules de levures (saccharomyces cerevisiae). Celles-ci servent
"d'usines" où ont été insérés les gènes du HPV, programmés pour
fabriquer la protéine d'enveloppe (appelée L1) de la capside virale (structure
qui entoure l'ADN viral). Ces protéines L1 sont recueillies et purifiées. Elle
peuvent ensuite s'assembler entre elles, 5 par 5, en formant des capsomères L1.
Ceux-ci s'assemblent ensuite entre eux, créant une capside vide que l'on nomme
"pseudo-particule virale" ou VLP puisqu'elle ne contient pas
l'ADN viral, et ne peut donc pas infecter les cellules ni se multiplier. Le
vaccin GARDASIL actuel contient donc 9 types de VLP. La monographie du vaccin
spécifie que ces VLP « ne contiennent pas d'ADN viral, elles ne
peuvent pas infecter les cellules, se multiplier, ni provoquer de
maladies ». Cette affirmation du laboratoire producteur sera remise en
question un peu plus loin.
L’adjuvant
est l'hydroxyphosphate d'aluminium amorphe (0,5 mg d'Al), beaucoup plus
immunogène que l'hydroxyde d'aluminium. Les additifs sont le borax (conservateur,
reprotoxique) et du polysorbate 80 (émulsifiant).
Son prix
de vente est de 136 €. Le schéma vaccinal est de 2 doses espacées de 6 mois
entre les âges de 9 et 14 ans et 3 doses à partir de 15 ans (0, 2 et 6 mois).
L'utilisation de simplement 2 doses avant l’âge de 15 ans est liée à une
meilleure réponse immunitaire à cet âge de la vie.
2.
L'autre vaccin recombinant dirigé contre les deux principaux types responsables
de cancers du col [16 et 18] a été commercialisé en 2007 sous le nom de
CERVARIX (laboratoire GSK). Ce vaccin est dit bivalent, car contenant seulement
2 "pseudo-particules virales" ou VLP qui sont également des
protéines "L1", composants de la capside des virus HPV 16 et 18. La
production de ces protéines d'enveloppe est obtenue par l'introduction des
gènes correspondants dans un "baculovirus" (virus contaminant
des insectes).
 Le
CERVARIX contient deux adjuvants, de l'hydroxyde d'aluminium (0,5 mg en Al) et
de l'ASO4 (squalène). Ce dernier adjuvant, utilisé pour le vaccin PANDEMRIX,
lors de la grippe H1N1 en 2009, est accusé d'être en lien avec la survenue de
cas de narcolepsies [5].
Le prix à la vente est de 110 €. Le schéma vaccinal est le même que pour son
concurrent.
Le
CERVARIX contient deux adjuvants, de l'hydroxyde d'aluminium (0,5 mg en Al) et
de l'ASO4 (squalène). Ce dernier adjuvant, utilisé pour le vaccin PANDEMRIX,
lors de la grippe H1N1 en 2009, est accusé d'être en lien avec la survenue de
cas de narcolepsies [5].
Le prix à la vente est de 110 €. Le schéma vaccinal est le même que pour son
concurrent.
Ces 2 vaccins ne sont pas interchangeables et toute
vaccination initiée avec l’un des deux doit être poursuivie avec le
même produit.
Les recommandations officielles des "autorités de santé":
Les
recommandations officielles françaises prévoient, en 2019, une vaccination
systématique de toutes les fillettes âgées de 11 à 14 ans, précisant que
cette vaccination est d'autant plus efficace que les jeunes filles n'ont pas
encore été exposées au risque d'infection à HPV (soit avant les premières
relations sexuelles). Il est également recommandé de réaliser un
"rattrapage" pour les jeunes filles entre 15 et 19 ans révolus (avec
le risque de vacciner des personnes déjà contaminées par un HPV comme nous le
reverrons).

Il
est également recommandé en France une vaccination des hommes ayant des
relations homosexuelles par le Gardasil 9, jusqu'à l'âge de 26 ans, en
prévention de verrues ano-génitales et des risques de cancers anogénitaux. A la
suite des recommandations de la Ligue contre le cancer, notre Ministre de la
Santé a déclaré début 2019 qu'elle était favorable à l'extension de cette
indication à tous les jeunes garçons, attendant avec impatience l'avis de la
HAS (Haute Autorité de Santé). En attendant cet avis, une
"expérimentation" d'incitation à la vaccination anti-HPV gratuite de
tous les collégien(ne)s doit débuter en Octobre 2019 dans deux régions (Grand
Est et Guyane) et se prolonger sur 3 années.
Cette
vaccination n'est pas (encore) imposée par la loi… mais cette obligation
semble être aussi dans les cartons (chez certains Sénateurs pour l'instant). La
France reste en effet le mauvais élève de la classe puisque le taux
d'adolescentes vaccinées stagne entre 15 et 20%. Le champion du monde est
l'Australie où il a été atteint une couverture vaccinale de presque 80% des
filles et de 75% pour les garçons, pays exemplaire pour une presse très crédule
qui proclame la prochaine disparition du cancer du col de l'utérus dans les
années à venir.
Que sait-on actuellement de l'efficacité des vaccins ?
Bien que
la vaccination soit souvent présentée comme étant la première arme de
prévention de la survenue ultérieure de cancers de l'utérus, il est bien
évident que cet argument n'est pour l'instant qu'une pure hypothèse. En effet
ces cancers ne se développant en moyenne qu'une quinzaine d'années après
l'infection locale par les HPV oncogènes, il nous faudra attendre encore
quelques temps pour que des études épidémiologiques sérieuses et indépendantes
démontrent le bien-fondé de cette théorie.
Dans
l'impossibilité initiale de prouver l'efficacité directe de ces vaccins sur le
cancer à éradiquer, l'industrie pharmaceutique s'est donc d'abord concentrée
sur la fabrication de copies des principaux virus responsables, les HPV 16 et
18, coupables du développement de la quasi-totalité des lésions précancéreuses
du col (au moins 70%). Ces deux génotypes constituent donc les composants
obligés des deux vaccins actuellement sur le marché. Ne pouvant pas estimer
directement l'action préventive espérée sur des lésions cancéreuses du col
utérin, les essais cliniques ont comparé (sujets vaccinées versus population
non vaccinée), la fréquence de lésions précancéreuses du col utérin de haut
grade (CIN-2 et CIN-3) associées à la présence des deux génotypes HPV à haut risques
(16, 18) contenues dans ces vaccins.
Or la question majeure concernant
l'évaluation de ce type de vaccin est de savoir s'il réduit non seulement les
lésions dysplasiques en lien avec des HPV 16 et 18, mais surtout le risque global
de cancer du col, quelque soit le génotype en cause.
Ces
études ont d'abord été pilotées par Merck [6], aux USA sous l'égide
bienveillante de la FDA (Food and drugs administration). En effet alors
qu'aucune menace épidémique ne concernait ce virus, Merck a obtenu en 2002, des
experts de la FDA une procédure accélérée d'homologation de leur vaccin
Gardasil. Ce passe-droit a ouvert la porte au développement d'essais cliniques
rapides et limités (efficacité sur la prévention des lésions précancéreuses des
seuls génotypes 16 et 18).
L'étude
initiale (dite "par protocole") concernait des jeunes femmes
de 16 à 26 ans, dont on avait vérifié au préalable qu'elles n'avaient pas déjà
été infectées par l'un des 2 génotypes vaccinaux majeurs (HPV 16 et 18). La
durée d'observation de l’efficacité sur la survenue de lésions dysplasiques de
haut grade (CIN 2 et 3) liées aux génotypes
16 et 18 fut brève, 1 an 1/2 en moyenne, et comparait une population vaccinée à une autre recevant un placebo. Si aucune lésion dysplasique dues à ces génotypes vaccinaux ne fut décrite dans le groupe vacciné, le degré d’efficacité dans la prévention des dysplasies associées à tous types de HPV n'était que de 16,9% par rapport au groupe
témoin, soit un taux non significatif. Ce résultat de l'étude primitive ne fut
bien sûr pas publié et l'on doit ce scoop à une journaliste et un gynécologue
[7] qui ont réussi à obtenir et exploiter minutieusement ces données auprès de la
FDA.
Dans
l'intervalle, une autre étude avait été mise en route, portant sur un
sous-groupe redéfini après le début de l'étude initiale, car sensée mieux
représenter la population à vacciner. Les femmes, du même groupe d'âge,
devaient également ne pas avoir été contaminées auparavant par l'un des 14
génotypes HPV oncogènes possibles. Le taux de réduction du risque de
dysplasies dues à n'importe quel génotype dans le groupe vacciné était cette
fois plus élevé, de 43 %, 3 ans 1/2 après la vaccination. Cependant ces
chiffres ont été calculés sur des sous-groupes dont la définition a changé
plusieurs fois en cours d'études et sur des analyses complémentaires complexes
définies à postériori, ce qui affaiblit le niveau de preuves selon la revue
indépendante médicale Prescrire [8].
|
|
| Taux de réduction du risque de dysplasie à la fin de l'étude (42 mois de recul) 43% dans la population vaccinée (trait plein)
versus placebo (pointillés)
|
Ces données paraissant par
ailleurs plutôt faibles par rapport à la fréquence très dominante des HPV 16 et
18 responsables en principe d’au moins 70% des lésions dysplasiques. Si le
chiffre de réduction du risque est nettement inférieur, on peut penser que
l'éradication des HPV 16 et 18 a pu laisser possiblement le champ libre à
d'autre virus oncogènes [9]. Ce phénomène de remplacement viral favorise
l'émergence d'autres virus HPV à haut risque, déplaçant ainsi le problème sans
le résoudre. Malgré ces résultats troublants, la FDA autorisa en 2006 la
commercialisation du Gardasil aux USA, seulement 9 mois après le début de cette
seconde étude. Celle-ci en était alors à ses balbutiements et ne fut publiée
qu'en 2010 [10]
Quand "Cochrane" s'en mêle…
Une
méta-analyse réalisée par la collaboration "Cochrane" a été publiée
en 2018 [11].
Celle-ci a intégré l’interprétation de 26 articles randomisées (vaccinées versus
témoins), dont 7 seulement testaient le Gardasil et 18 concernaient le
Cervarix. Parmi ces articles, 10 publications ont étudié la protection contre
l'apparition de dysplasies de haut grade (CIN-2 et CIN-3) chez des femmes âgées
de 15 à 26 ans sur un suivi allant de 3 ans 1/2 à 8 ans. Les conclusions
globales semblent favorables quant à l’évaluation de l’efficacité des deux
vaccins.
- La
protection est très efficace, chez les sujets initialement indemnes de
contamination par les HPV 16 ou 18, ou ne possédant aucuns typages de HPV à
haut risque cancérigène. Chez ces femmes non contaminées, la vaccination réduit
significativement (efficacité de 95%) l'apparition de tous types de dysplasies
associée aux HPV 16 et 18, par rapport à un placebo.
- Par contre
le risque relatif de voir survenir des lésions dysplasiques dues à tous types
de virus HPV (sauf les typages 16 et 18) est plus élevé par rapport aux femmes
non vaccinées. Si l'on comptabilise toutes les lésions CIN-3, ce risque
augmente après une vaccination bivalente Cervarix (0,55) et encore plus avec
le quadrivalent Gardasil (0,81), soit des efficacités respectives de 45%
et 19%.
- Les
vaccinations réalisées chez des femmes âgées de 25 à 45 ans sont totalement inefficaces, probablement en lien avec une infection antérieure à
HPV.
Depuis
l'acquisition de ce « label Cochrane », les autorités sanitaires sont
confortées dans leurs projets de convaincre les derniers parents réticents et
les médecins hésitants. Mais, alors que cette collaboration avait acquis jusque-là une notoriété d'indépendance et de transparence sans failles, une
contestation bruyante est apparue en son sein emmenée par le Dr. Peter
Gøtzsche, membre fondateur et pilier de l'organisation. Ce dernier l'a
lourdement payé en étant démis de ses fonctions après avoir osé pointer les
failles de cette publication "complaisante"[12].
Quelles sont donc
ces critiques émises envers cette méta-analyse "made in Cochrane"
- Les
résultats aboutissant à un taux d'efficacité vaccinale globale, mixent des
données déséquilibrées en nombre d'études (18 sur le Cervarix contre simplement
7 sur le Gardasil alors que c'est ce dernier vaccin qui est utilisé à une très
large majorité dans tous les pays industrialisés). Non inclusion d'au moins une
étude concernant le Gardasil 9 qui a remplacé le premier vaccin quadrivalent.
Un mélange d'études concernant 2 vaccins de compositions différentes (sur le
nombre de génotypes viraux et de leurs adjuvants) pose un problème
méthodologique également gênant.
- L'autre
reproche important est le choix unique de publications commanditées par les
deux laboratoires producteurs, et laissant forcément des doutes sur la
neutralité des résultats bien que les auteurs de Cochrane écrivent benoîtement que ces publications "étaient à faible risque de biais". Les
auteurs ont de plus ignoré presque la moitié des articles éligibles, dont les
fameuses données d'efficacité (ou plutôt de non efficacité) non publiées par le
laboratoire Merck sur les essais initiaux du Gardasil. Dans le même registre de
partialité, cet article a été corédigé par 6 auteurs, tous Britanniques, dont
3 ayant (ou ayant eu) des liens d’intérêts avec l'industrie du vaccin
anti-HPV.
- Le
principe d'accepter, sans sourciller, que les études sur les effets
indésirables s'établissent en comparant un vaccin avec un soi-disant
"placebo" contenant en fait un adjuvant aluminique, mettant à mal la
définition même du placebo.
- La
critique du médecin Danois dénonçait enfin surtout les risques de cette
vaccination capable de déclencher à son avis de graves dommages neurologiques,
ce que les auteurs banalisent ou ignorent.
Une méta-analyse récente (2020), portant sur 12 études randomisées, a été publiée dans le prestigieux journal de la Royal Society of Medicine [21]. Elle vient confirmer le doute sérieux qui existe sur l'efficacité réelle de ces 2 vaccins dans la prévention du cancer du col de l'utérus. Le choix des populations testées ne reflète pas forcément (âge) la cible de cette prévention vaccinale (adolescents). L'efficacité des vaccins sur la prévention des lésions CIN 1 n'a aucun intérêt pratique puisque ces lésions guérissent spontanément. Le mélange de lésions cervicales de tous les grades (CIN 1, 2, 3 et adénocarcinome in situ) ne signifie nullement une efficacité sur les lésions les plus graves (CIN 3 et pré-cancer) pour lesquelles il existe très peu de données. La surveillance de l'évolution des lésions CIN a été de trop courte durée (6-12 mois et le plus souvent moins de 6 mois) alors que l'intervalle habituel de surveillance est de 36 mois pour avoir un recul évolutif suffisant. Ces essais ont donc pu surestimer l'efficacité vaccinale pour des lésions qui auraient probablement régressé spontanément
Quels renseignements peut-on tirer de l'expérience des pays à très fort taux de vaccinations ?
 |
Incidence du cancer du col
en Australie (1982-2014) |
Voyons ce qui se passe en
Australie puisque ce paysdétient la médaille d'or de la
vaccination anti-HPV. La campagne vaccinale a débuté en 2007
chez les fillettes, avec un taux qui frise actuellement les 80%.
Ce pays a ensuite inclus un plan de vaccination généralisée
de ses pré-adolescents en 2011. Un dépistage organisé des
cancers du col par frottis avait été mis en place en 1991. Grâce
à ce dépistage, l'incidence du cancer du col avait diminué
de plus de moitié, passant de 15 cas/100.000 en 1982 à
7/100.000 en 2004. Mais depuis cette date l'incidence ne
baisse plus, malgré une vaccination
massive débutée en 2007
Les médias ont pourtant relayé l'annonce d'une future éradication des
cancers du col dans ce pays, ce qui ne repose que sur des calculs statistiques
aléatoires
[13] et ne semble pas encore à l'ordre du jour. L'une des raisons de cette
stagnation de l'incidence des cancers pourrait être la baisse du dépistage chez
les femmes vaccinées qui se croient à tort, protégées définitivement par le
vaccin. Par ailleurs, un effet paradoxal semble exister dans la mesure ou
l'incidence des cancers du col augmente dans les classes d'âge des femmes
vaccinées. Ainsi, dans la tranche d'âge des 25-29 ans (vaccinées entre les âges
de 18 et 22 ans), l'incidence est passée en 7 ans de 5,9 à 8 cas/100.000 entre
les années 2007 et 2014. Durant la même période, cette incidence reste similaire
ou diminue chez les femmes plus âgées, donc non vaccinées mais continuant à
bénéficier du simple dépistage par frottis.
Médaille
d'argent, la Grande Bretagne a débuté sa campagne de vaccination en 2008, en
obtenant une couverture de plus de 85% d'adolescentes, après avoir débuté un
dépistage des dysplasies du col en 1988. Ce dépistage organisé avait permis une baisse de l'incidence du cancer du col de 14/100.000 en 1993 à 9,4/100 000 en 2007, année précédant le début de la vaccination. Depuis cette date, ce chiffre global, tous âges confondus, stagne, étant à 9,6 en 2015.
Incidence globale Grande Bretagne (1993-2014)
 |
Incidence du cancer du col selon
la tranche d'âge G.B.(1993-2014) |
|
Si l'on
détaille cette période post-vaccinale, 2008-2014, selon les tranches d'âge, on
s'aperçoit que l'incidence du cancer a diminué chez les femmes les plus âgées,
après 50 ans. Par contre, ce chiffre a augmenté chez les femmes les plus jeunes
de la population Britannique:
- Dans le
groupe d'âge 20-24 ans, l'incidence
est de 3,1 en 2008 à 4/100.000 en 2016. - Dans le groupe d'âge 25-34 ans, cette donnée est passée de 16,9 en 2008 à 19,7/100.000 en 2016
Si l'on se penche sur la
seule région Anglaise,
le changement est encore plus marqué.
Dans la tranche d'âge 25-29
ans (points rouges), l'incidence du cancer du col chez les jeunes Anglaises a doublé en 7 ans
passant de 11 en 2007 à plus de 22/100.000 en 2015. Les courbes
sont assez similaires pour les jeunes femmes Écossaises et Galloises. Or
c'est dans ce créneau d'âge que l'on retrouve toutes les adolescentes ou jeunes
femmes ayant pu recevoir une vaccination antérieure, dont certaines tardivement
(vaccins dits de "rattrapage" après 16 ans).
L'une des hypothèses émises
pour expliquer ces hausses rapides est celle d'une exposition plus importante
et plus précoce aux HPV chez les adolescentes anglaises. L'autre explication
repose sur une technologie plus fine
de l'étude microscopique des frottis, dépistant des micro-cancers, voire des sur-diagnostics [14].
Quel est
l'impact de la vaccination anti-HPV préalable dans cette augmentation
significative des cancers du col à un âge inhabituellement précoce, en
particulier lorsqu'une infection à HPV préexiste ? Le doute existe
sérieusement…
 |
Incidence 2006-2015 selon les
tranches d'âge, 20-49 ans (traits pleins)
et > 50 ans (pointillés) |
|
|
En Suède,
le vaccin Gardasil a été introduit en 2006 et le programme de vaccination des pré-adolescentes a a été débuté en 2010 pour atteindre une large couver- ture approchant les 80% avec un "rattrapage" des jeunes filles les plus âgées (18 ans) L'incidence globale
des cancers du col a cru progressivement depuis 2006 où elle était alors de 9,7 pour atteindre le chiffre de 14/100.000 femmes (2016).
Cette
augmentation a touché en fait essentiellement les tranches les plus jeunes de
la population féminine, ayant donc été soumises à une vaccination préalable.
L'incidence a en effet augmenté en 10 ans dans la tranche des 20/24 ans,
passant de 1,9 en 2006 à 3,3/100.000 en 2016, tandis que pour la tranche d'âge des 25/29 ans, elle évoluait durant
la même période de 8,9 à 11,9/100.000 [15].
On voit que globalement, seule la population regroupant les femmes âgées de 20 à 49
ans (courbe en traits pleins) présente une augmentation de l'incidence du cancer du col depuis l'année
2005/2006, comme on l'observe sur le graphique ci-dessus. L'incidence augmente
d'un tiers passant en 10 ans de 10,7 en 2006 à 15,7/100.000 en 2016. A contrario,
la population âgée de plus de 50 ans (courbe en pointillé) ne subit aucune majoration de la fréquence
de ce cancer du col.
 |
| Incidence Norvège (1955-2015) |
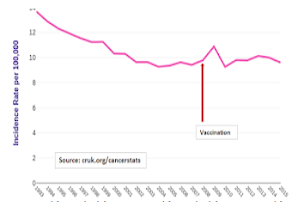
La Norvège a une politique
similaire de prévention. Un dépistage organisé par frottis du col est proposé
depuis 1995 et la vaccination anti-HPV des pré-adolescentes depuis l'année
2009.
L'incidence des
cancers du col a suivi une régression jusqu'en 2007 avec un chiffre de
9,1/100.000 en 2008 et un plateau légèrement ascendant depuis avec 9,7
cas/100.000 en 2017.
Par contre, l'incidence
chez les femmes de la tranche d'âge de 20/24 ans qui ont été en majorité
vaccinées a nettement augmenté passant de 2,9 en 2006 à 7,8/100.000 en 2016.
Beaucoup
d'inconnues restent donc en suspens quant à la réelle efficacité des vaccins
anti-HPV.
- En
premier lieu, cette progression récente et constante du nombre de cancers du
col dans des populations largement vaccinées interroge à juste titre [16].
- Si des
adolescentes sont effectivement immunisées contre certaines souches oncogènes
(HPV 16, 18 et autres), qui peut être certain que d'autres génotypes viraux ne
viendront pas proliférer à leur place ? Est-ce que la vaccination ne serait pas
capable de réactiver des HPV non ciblés par le vaccin ? Ce phénomène de
remplacement de la prévalence des souches de HPV a été constaté chez des
adolescentes ou jeunes femmes préalablement vaccinées par le Gardasil. Une
réactivation avec prolifération pour les types de HPV 52 et 56, à risque
oncogénique et non ciblés par le vaccin, a pu être ainsi observée au niveau du
tractus génital [17]
- L'étude
pivot de Merck concernant l'évaluation initiale du Gardasil, et destinée à la
FDA, avait inclus des personnes (dénommées "non naïves") qui avaient
été contaminées préalablement par des souches virales oncogènes (en particulier
16 et 18). Les résultats de ce sous-groupe avaient retrouvé une augmentation
(26%) de l'apparition de lésions dysplasiques du col par rapport au groupe
placebo.
Or la
contamination par les HPV n'est pas toujours sexuelle. Un enfant peut être
contaminé par voie cutanée ou voie génitale à sa naissance, ce type de virus
étant très résistant à un environnement inhabituel et aux antiseptiques [18].
S'il persiste, quel sera le risque de vacciner une adolescente déjà porteuse
d'un virus HPV ?
- La
disparition des HPV des voies génitales après une contamination peut rester
incertaine malgré l'existence de prélèvements virologiques négatifs. Prouver
que le HPV n'est plus présent est impossible [19] et une
réactivation virale peut donc ultérieurement se mettre en place.
Il
parait donc crucial de n'utiliser ces vaccins que chez des individus
"naïfs" de toute contamination préalable avec des HPV oncogènes.
- Quelle
est la durée de protection éventuelle des vaccins anti-HPV réalisées chez des
pré-adolescentes de 11-12 ans contre les génotypes censés être principalement
ciblés (HPV 16 et 18) ? Dans une étude regroupant 17.622 femmes vaccinées par
un schéma à 3 doses, le taux des anticorps anti-HPV 18 est devenu négatif dans
40% des cas 4 années plus tard [20].
- Est-ce
qu'une protection contre les HPV oncogènes est synonyme d'éviction des cancers
du col utérin qui apparaissent la plus part du temps de façon très décalée par
rapport à la colonisation virale. Aucune étude à long terme n'a été menée dans
ce sens, puisque le recul du début de ces vaccinations est insuffisant.
Dominique LE HOUÉZEC, Pédiatre.
conflits d’intérêt: néant (Sauf
l’intérêt de l’enfant)
Bibliographie:
[1] BOSCH FX
et coll. Chapter 1. Human papillomavirus and cervical cancer. Burden
and assessment of causality. Journal of the National Cancer Institute
Monographs.31:3–13 (2003).
[2] JACQUART AC. et coll. Distribution des génotypes de HPV dans les lésions génitales en France: étude Edith. BEH 2009; 29: 313-317
[3] SYRJÂNEN K.
New concepts on risk factors of HPV and novel screening strategies for
cervical cancer precursors. Eur J Gynaecol Oncol. 2008;29 (3) 205-21
[5] MILLER E.
Risk of narcolepsy in children and young people receiving AS03
adjuvanted pandemic A/H1N1 2009 influenza vaccine: retrospective
analysis. BMJ 2013;346:f794
[6] Le laboratoire Merck est le
deuxième groupe pharmaceutique mondial depuis sa fusion avec
Shering-Plough. Merck s'est illustré en 2005 par la découverte du
scandale de l'anti-inflammatoire VIOXX qui s'est éteint grâce au
versement de près de 5 milliards de $ pour mettre un terme aux
poursuites judiciaires (La FDA estime à environ 28.000 le nombre de
victimes décédées ou ayant fait l'objet de complications cardiaques).
[7] RIVA C. et SPINOSA J.P. La piqûre de trop. Pourquoi vaccine-t-on les jeunes
filles contre le cancer du col de l’utérus ? Ed. Xenia, Vevey, 2010 [8] RIVA C, SPINOSA JP. Prescrire en questions: vaccin papillomavirus: quelle efficacité, quel risque? La Revue Prescrire 2013;33(357):552-556.
[9] MURALL CL, McCANN KS, BAUCH CT. Revising ecological assumptions about
Human papillomavirus interactions and type replacement. J Theor Biol.
2014 Jun 7;350:98-109. doi: 10.1016/j.jtbi.2013.12.028.
[10] MUNOZ N et
coll. Impact of human papillomavirus (HPV)-6/11/16/18 vaccine on all
HPV-associated genital diseases in young women. J. Nat Cancer Inst. 2010
(5):325-339
[11] ARBYN M. XU L. SIMOENS C.
Prophylactic vaccination against human papillomaviruses to prevent
cervical cancer and its precursors. Cochrane Database Syst Rev. 2018
May9;5
[12] JORGENSEN.L, GOTZSCHE P.C.,
JEFFERSON T. The Cochrane HPV vaccine review was incomplete and ignored
important evidence of bias. BMJ evidence based medecine.
2018;23,5:165-168
[13] HALL M.T. et coll. The projected timeframe until cervical cancer elimination in Australia: a modelling study. The Lancet 2019; 4, 1: 19-27
[14] CASTANON A. Is
the recent increase in cervical cancer in women aged 20–24 years in
England a cause for concern? Preventive Medicien. 2018 107: 21-28
[15] ANDERSSON L.Increased incidence of cervical cancer in Sweden: Possible link with HPV vaccination. Indian Journal of medical ethics. 2018 doi:
10.20529/IJME.2018.037 (L'article a été signé sous un pseudonyme,
l'auteur craignant des répercussions personnelles du fait des critiques
concernant une vaccination. Son éditeur a déclaré l'article retiré un
mois plus tard, disant ne pas pouvoir retrouver l'auteur réel...)
[16] DELEPINE N. et G. Hystérie vaccinale. Vaccin Garadasil et cancer: un paradoxe. fauves éditions (2018)
[17] SABEENA S.
Possible non‐sexual modes of transmission of human papilloma virus. The
journal of obstetrics and gynaecology research. 2017;43, 3: 429-435
[18] SODERLUND-STRAND A. et coll. Change in population prevalences
of human papillomavirus after initiation of vaccination: The
high-throughput HPV monitoring study. Cancer Epidemiol Biomarkers Prev. 2014;23(12):2757-64
[19] BROWN DR et coll. Human papillomavirus in older women: new infection or reactivation? J Infect Dis. 2013 Jan 15;207(2):211-12
[20] JOURA E.A. et coll. HPV antibody levels and clinical efficacity following administrationof a prophylactic quadrivalent HPV vaccine : 2008; 26, 52: 68446851
[21] REES C.P. et coll. WillHPV vaccination orevent cervical cancer? Journal of the RoyalSociety of Medicine. 2020;113 (2):64-78
 Certains papillomavirus humains peuvent entrainer, à l'occasion de rapports sexuels, une
contamination génitale qui peut parfois diffuser sur le
col de l'utérus. Cette infection guérit spontanément dans la majorité des cas mais
peut aussi aboutir à une infection chronique qui colonise certaines
cellules du col utérin, risquant à long terme de dégénérer en cancer du
col. Afin de prévenir ces infections génitales, une vaccination ciblée
sur ces virus spécifiques est proposée aux jeunes
filles pré-adolescentes avant le début de leur vie sexuelle. Des
polémiques existent cependant depuis le début de leur utilisation
portant à la fois sur une efficacité hypothétique et aussi sur la
possibilité de survenue d'effets indésirables graves.
Certains papillomavirus humains peuvent entrainer, à l'occasion de rapports sexuels, une
contamination génitale qui peut parfois diffuser sur le
col de l'utérus. Cette infection guérit spontanément dans la majorité des cas mais
peut aussi aboutir à une infection chronique qui colonise certaines
cellules du col utérin, risquant à long terme de dégénérer en cancer du
col. Afin de prévenir ces infections génitales, une vaccination ciblée
sur ces virus spécifiques est proposée aux jeunes
filles pré-adolescentes avant le début de leur vie sexuelle. Des
polémiques existent cependant depuis le début de leur utilisation
portant à la fois sur une efficacité hypothétique et aussi sur la
possibilité de survenue d'effets indésirables graves.





 Les pays
en voie de développement regroupent 83 % des nouveaux cas de cancer car
l’accès limité à un dépistage efficace signifie que la maladie n’est souvent
identifiée qu'à un stade avancé. En Afrique subsaharienne, l'incidence annuelle
est de 35/100.000.
Cette fréquence culmine dans les pays d'Afrique du Sud ou l'incidence annuelle
peut dépasser 60/100.000. En outre, les perspectives de traitement de cette
maladie à un stade très avancé sont assez médiocres, d’où un taux de décès plus
important dans ces régions où le cancer du col est la principale cause de
mortalité féminine.
Les pays
en voie de développement regroupent 83 % des nouveaux cas de cancer car
l’accès limité à un dépistage efficace signifie que la maladie n’est souvent
identifiée qu'à un stade avancé. En Afrique subsaharienne, l'incidence annuelle
est de 35/100.000.
Cette fréquence culmine dans les pays d'Afrique du Sud ou l'incidence annuelle
peut dépasser 60/100.000. En outre, les perspectives de traitement de cette
maladie à un stade très avancé sont assez médiocres, d’où un taux de décès plus
important dans ces régions où le cancer du col est la principale cause de
mortalité féminine. Ces deux
vaccins recombinants sont préparés par "génie génétique" à partir de
cellules de levures (saccharomyces cerevisiae). Celles-ci servent
"d'usines" où ont été insérés les gènes du HPV, programmés pour
fabriquer la protéine d'enveloppe (appelée L1) de la capside virale (structure
qui entoure l'ADN viral). Ces protéines L1 sont recueillies et purifiées. Elle
peuvent ensuite s'assembler entre elles, 5 par 5, en formant des capsomères L1.
Ceux-ci s'assemblent ensuite entre eux, créant une capside vide que l'on nomme
"pseudo-particule virale" ou VLP puisqu'elle ne contient pas
l'ADN viral, et ne peut donc pas infecter les cellules ni se multiplier. Le
vaccin GARDASIL actuel contient donc 9 types de VLP. La monographie du vaccin
spécifie que ces VLP « ne contiennent pas d'ADN viral, elles ne
peuvent pas infecter les cellules, se multiplier, ni provoquer de
maladies ». Cette affirmation du laboratoire producteur sera remise en
question un peu plus loin.
Ces deux
vaccins recombinants sont préparés par "génie génétique" à partir de
cellules de levures (saccharomyces cerevisiae). Celles-ci servent
"d'usines" où ont été insérés les gènes du HPV, programmés pour
fabriquer la protéine d'enveloppe (appelée L1) de la capside virale (structure
qui entoure l'ADN viral). Ces protéines L1 sont recueillies et purifiées. Elle
peuvent ensuite s'assembler entre elles, 5 par 5, en formant des capsomères L1.
Ceux-ci s'assemblent ensuite entre eux, créant une capside vide que l'on nomme
"pseudo-particule virale" ou VLP puisqu'elle ne contient pas
l'ADN viral, et ne peut donc pas infecter les cellules ni se multiplier. Le
vaccin GARDASIL actuel contient donc 9 types de VLP. La monographie du vaccin
spécifie que ces VLP « ne contiennent pas d'ADN viral, elles ne
peuvent pas infecter les cellules, se multiplier, ni provoquer de
maladies ». Cette affirmation du laboratoire producteur sera remise en
question un peu plus loin. Le
CERVARIX contient deux adjuvants, de l'hydroxyde d'aluminium (0,5 mg en Al) et
de l'ASO4 (squalène). Ce dernier adjuvant, utilisé pour le vaccin PANDEMRIX,
lors de la grippe H1N1 en 2009, est accusé d'être en lien avec la survenue de
cas de narcolepsies [5].
Le prix à la vente est de 110 €. Le schéma vaccinal est le même que pour son
concurrent.
Le
CERVARIX contient deux adjuvants, de l'hydroxyde d'aluminium (0,5 mg en Al) et
de l'ASO4 (squalène). Ce dernier adjuvant, utilisé pour le vaccin PANDEMRIX,
lors de la grippe H1N1 en 2009, est accusé d'être en lien avec la survenue de
cas de narcolepsies [5].
Le prix à la vente est de 110 €. Le schéma vaccinal est le même que pour son
concurrent.









Bonjour,
RépondreSupprimerJuste pour info, l'article sur la Suède a été rétracté.
Vous avez raison, cet article a été retiré du journal, je le signale dans la bibliographie.La raison officielle n'en est pas le contenu (les chiffres utilisés concernant l'incidence sont exacts, issus de la base de données sur les cancers NordCan) mais le fait que l'auteur ait signé sous un pseudonyme. Merci de votre remarque qui indique que ce sujet vous intéresse.
Supprimer